L'histoire de l'utilisation de l'or en médecine
Depuis sa découverte, les gens ont considéré l'or comme ayant des propriétés d’immortalité en raison de sa résistance à la corrosion et à l'oxydation. Par conséquent, l'or a d'abord été utilisé pour rechercher la longévité dans de nombreuses cultures anciennes en Inde, en Égypte et en Chine. Les premières preuves de l'utilisation de l'or pour soigner des maladies remontent à 2500 avant J.-C. en Chine. L'or était alors largement utilisé par les anciens médecins et chirurgiens chinois, notamment en cas de fièvre, de rougeole ou d'infection en général (1). Dans le monde occidental, l'or était également déifié en raison du lien qu'il pouvait avoir avec la lumière chaude et vivifiante du soleil.

Minerai d'or | Crédits : Aree Chitprasartchai
L'or dans la médecine rationnelle moderne
Robert Koch (1843-1910) est l'un des plus grands biologistes de son temps. Il a reçu le prix Nobel de médecine en 1905 pour ses recherches sur la tuberculose (il a découvert l'agent causal de cette maladie). Il est également connu pour avoir créé le "postulat de Koch", qui est toujours utilisé pour relier un agent pathogène à une maladie. Il est considéré comme l'un des pères de la médecine moderne avec Louis Pasteur et Joseph Lister. Au cours de ses travaux sur la tuberculose, Robert Koch a découvert en 1880 que le cyanure d'or, K[Au(CN)2], était bactériostatique pour cet agent de la tuberculose. À l'époque, il n'existait aucun traitement pour la tuberculose et, en l'espace de 10 à 15 ans, le monde entier a donc utilisé l'or comme étalon-or pour traiter la tuberculose. La suggestion (erronée) que le même agent pouvait être responsable de la polyarthrite rhumatoïde a conduit à l'utilisation de la thérapie par l'or pour cette maladie également. Jacques Forestier, un médecin français, a été le premier à en faire état en 1928. Il a traité son patient avec 50 mg de sulfonate d'or thiopropanol sodique (Allochrysine) en injections intramusculaires hebdomadaires (3).
La thérapie à l'or s'est rapidement avérée inefficace contre la tuberculose. Après 30 ans de débat sur l'efficacité de la thérapie à l'or dans le traitement de la polyarthrite rhumatoïde et après une étude clinique parrainée par l'Empire Rheumatism Council, il a finalement été rapporté en 1961, que la thérapie à l'or est efficace contre cette maladie (4).
À l'heure actuelle, outre l'allochrysine qui est toujours administrée par voie intramusculaire, un autre médicament est approuvé par la FDA pour le traitement de la polyarthrite rhumatoïde, l'Auranofin. L'Auranofin a été approuvé en 1985. Il s'agit d'un médicament oral à prendre deux fois par jour. Les recherches sur l'utilisation de l'or en médecine se poursuivent. Par exemple, il a été démontré très récemment que l'Auranofin est capable d'inhiber la réplication du Sars-CoV-2 et d'atténuer l'inflammation dans les cellules humaines (5).
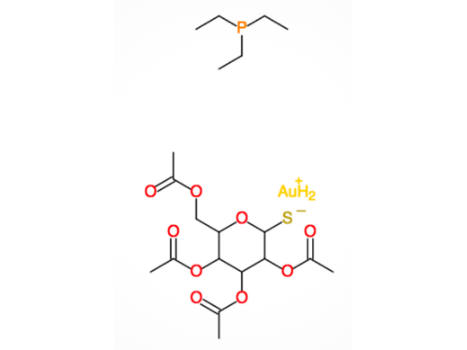
Formule chimique de l'Auranofin
Une nouvelle utilisation de l'or en médecine
À l'exception de ceux décrits précédemment, il n'y a pratiquement aucun médicament contenant de l'or disponible sur le marché. En particulier depuis les travaux de Turkevich sur les nanoparticules d'or, une quantité énorme de travail est effectuée pour appliquer les nombreuses capacités de ces nanoparticules en clinique.
Dans notre société, les nanoparticules ont une réputation injuste car elles sont généralement considérées comme polluantes et toxiques même s’il est vrai que les nanoparticules indésirables rejetées dans l'atmosphère par les automobiles et les grandes industries sont mauvaises pour notre environnement et notre santé. En raison de leur petite taille (de l'ordre de celle d'un virus), les nanoparticules peuvent pénétrer dans le corps humain, les organes et les cellules et avoir un impact sur ces derniers. Néanmoins, cette même propriété, lorsqu'elle est maîtrisée et bien optimisée, fait de ces nanoparticules de formidables outils pour cibler, visualiser et traiter les maladies.
C'est pourquoi de nombreux laboratoires travaillent sur les nanoparticules, et notamment les nanoparticules d'orqui sont hautement biocompatibles. Grâce à leurs propriétés optiques, électroniques et de reconnaissance moléculaire, les nanoparticules d'or peuvent être utilisées pour différentes fonctionnalités en les transformant en un outil nommé nanothéranostique (nanoparticules conçues pour la thérapie et le diagnostic).
La première étape pour traiter une maladie est d'abord de diagnostiquer le patient. Dans cette optique, les nanoparticules d’or ont récemment attiré l’attention en tant qu’agent de contraste aux rayons X grâce à leur grande capacité d’atténuation des rayons X ainsi qu’à leur facilité à être fonctionnalisée. D'autant plus qu'il n'y a pratiquement pas eu de nouvelles améliorations de l'agent de contraste clinique aux rayons X au cours des 25 dernières années. La plateforme chimique reste le tri-iodobenzène avec ses limites connues (temps d'imagerie court, nécessité d'un cathétérisme dans de nombreux cas, toxicité rénale occasionnelle et faible puissance de contraste chez les patients de grande taille). Les nanoparticules d'or peuvent surmonter ces limites (6).
À notre connaissance, aucune nanoparticule d'or n'est encore utilisée comme agent de contraste en clinique. Dans le projet Projet NT1notre objectif est de combiner la propriété de cet agent de contraste afin de mieux visualiser. Tumeur de la peau ainsi que de confirmer l'internalisation de notre produit avant d'appliquer un laser proche infrarouge (voir thérapie photothermique) pour chauffer la tumeur.

Les nanoparticules d'or de TORSKAL synthétisées à partir de la chimie verte, d'extraits de plantes lyophilisées, de poudre de plantes et de feuilles de plantes séchées.
Les nanoparticules d'or sont faciles à fonctionnaliser avec des peptides ou des anticorps permettant de cibler des organes ou des cellules spécifiques, ce qui en fait déjà de bons vecteurs de potentiels médicaments. De plus, le transport des nanoparticules d'or vers les tissus tumoraux est facilité par l'effet accru de perméabilité et de rétention (EPR). Il s'agit d'un phénomène caractéristique des tumeurs solides. Pour se nourrir efficacement, le tissu tumoral a besoin d'une grande quantité de nutriments et d'oxygène, car les nouveaux vaisseaux sanguins se forment rapidement et sont "fuyants", ce qui entraîne une accumulation de sang dans la tumeur, de macromolécules et de nanoparticules en cas d'injection intraveineuse (7).
Trois essais cliniques, utilisant des nanoparticules d'or comme vecteur de médicament, sont rapportés site web des essais cliniques. Deux essais cliniques ont débuté en 2006 avec le CYT-6091, une nanosphère d'or de 27 nm transportant le facteur de nécrose tumorale (TNF) pour traiter les tumeurs solides avancées (NCT00356980) et le cancer solide primaire ou métastatique (NCT00436410). Ces deux essais montrent une bonne distribution apparente du TNF dans la tumeur (8). Le deuxième "médicament-nanoparticule" testé en clinique est le NU-0129. Il s'agit d'une nanosphère d'or portant un fragment d'ARN ciblant le gène Bcl2L12 (associé à la croissance tumorale) dans les glioblastomes et gliosarcomes récurrents. L'essai clinique a débuté en 2017 (NCT03020017) et, là encore, une bonne distribution dans les tumeurs a été observée (9).
La radiothérapie est l'un des principaux outils de la lutte contre le cancer. Bien qu'elle soit très efficace pour tuer les cellules tumorales, elle cause des dommages collatéraux aux cellules saines situées à proximité. En général, l'utilisation d'amplificateurs radioélectriques permettra d'augmenter l'efficacité de la destruction des cellules tumorales avec une plus faible quantité de rayonnement, et donc une diminution des dommages collatéraux. Parmi les les amplificateurs de radiothérapie potentiels, les nanoparticules d'or sont particulièrement intéressantes en raison de leur numéro atomique élevé (10). Dans notre NT2 - Projet "Deep Cancernous optimisons notre produit pour qu'il soit un amplificateur de radiothérapie efficace qui sera utilisé dans les cancers profonds.
La thérapie photothermique (TPT) est un traitement médical local consistant en une "plateforme" chimique (ici des nanoparticules d'or) qui va chauffer lorsqu'elle est combinée à une photothérapie spécifique : le laser proche infrarouge (NIR). Une augmentation de température de 7°C est suffisante pour tuer les cellules tumorales car le laser NIR et les nanoparticules d'or sont inertes seuls. Cette thérapie présente le grand avantage d'un double ciblage, permettant, en théorie, une diminution des effets indésirables. C'est pourquoi, la TPT est la principale thérapie utilisant des nanoparticules d'or rapportée sur le site web des essais cliniques.
Nanospectra a parrainé 4 essais cliniques utilisant son Auroshell comme plateforme pour les TPT afin de traiter le cancer du poumon (NCT01679470), les tumeurs de la tête et du cou (NCT00848042) et les néoplasmes de la prostate (NCT02680535 ; NCT04240639). La TPT utilisant des nanoparticules d'or hybrides (nanoparticule d'or-silice) a également été testée pour d'autres maladies, comme l'athérosclérose (NCT01270139 ; NCT01436123) ou l'acné (NCT02219074 ; NCT02217228 ; NCT02758041 ; NCT03303170 ; NCT03573115 ; NCT03818555) 11. Enfin, cette plateforme silice-or a été approuvée par la FDA. Notre Produit NT1 atteindra bientôt l'essai clinique (d'ici début 2023) dans le traitement du cancer de la peau par la combinaison de ,
- L'injection intratumorale de notre produit
- L'imagerie radiographique de notre produit pour précisément définir la tumeur
- L'irradiation au laser NIR pour "brûler" les cellules tumorales avec un minimum de dommages collatéraux.
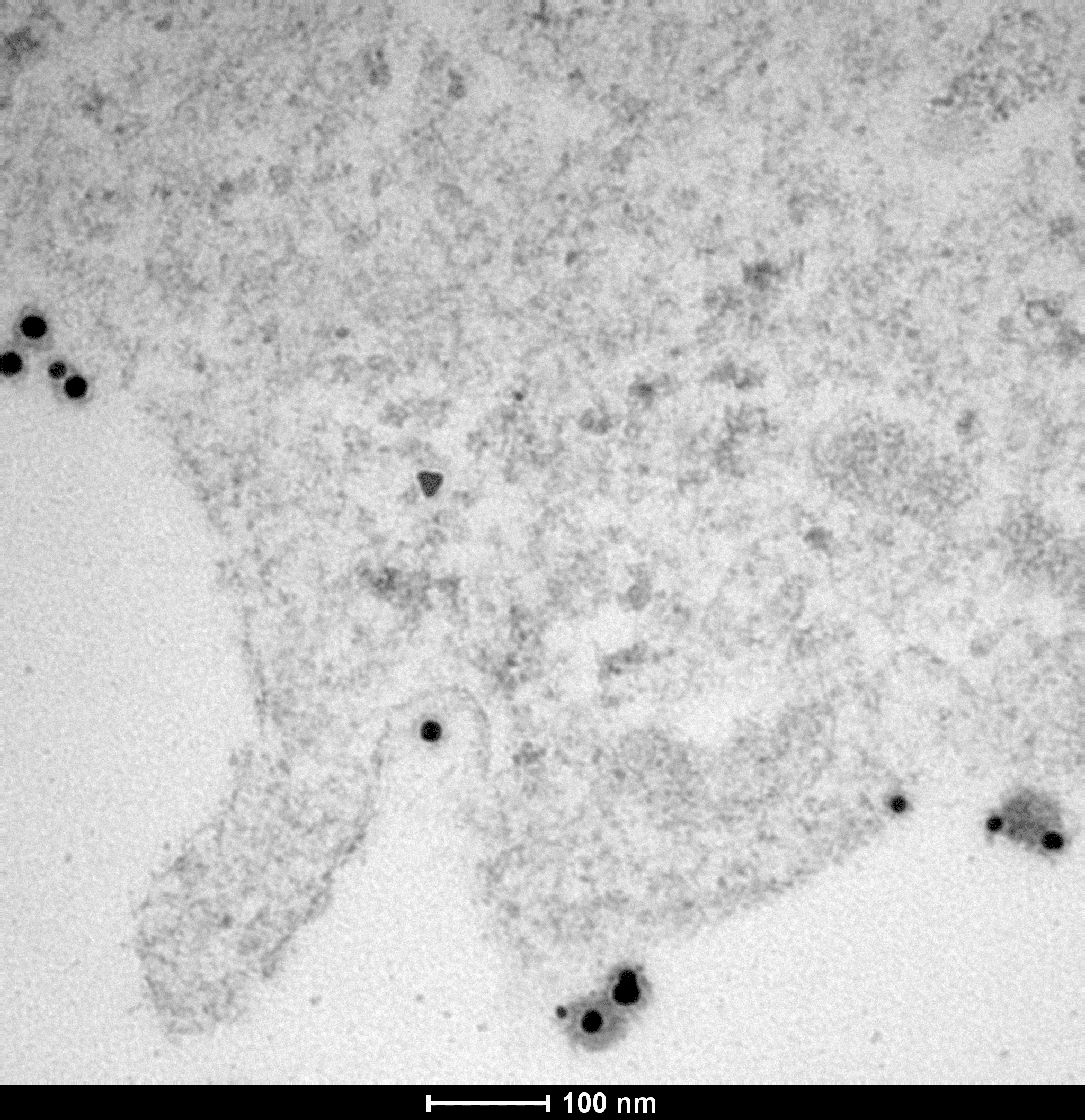
Nos nanoparticules d'or pénétrant dans une cellule de mélanome
La nanoparticule d'or la plus avancée agissant réellement comme un médicament direct est le CNM-Au8, un nanocristal d'or conçu par Clene Nanomedecine. Habituellement, les nanoparticules d'or sont Synthétisées par réduction de sels d'or. Au contraire, CNM-Au8 a été synthétisé par une méthode basée sur l'électro-cristallisation. Cela confère une activité catalytique unique à CNM-Au8. Sept essais cliniques de phase II sont en cours, principalement sur des troubles neurodégénératifs : Sclérose en plaques rémittente (NCT03993171), maladie de Parkinson (NCT03815916 ; NCT03536559), sclérose latérale amyotrophique (SLA) (NCT03843710 ; NCT04081714 ; NCT04098406 ; NCT04297683) et la FDA américaine a accordé à CNM-Au8 le statut de médicament orphelin pour le traitement de la SLA en juillet 2019.
